Выше мы уже упоминали о том, что подавляющее большинство встречающихся в природе минералов представлено химическими соединениями. Среди последних различают:
- а) определенные соединения, как простые, так и двойные, и
- б) соединения переменного состава .
Широким распространением пользуются также твердые растворы , или так называемые изоморфные смеси . От этих истинных твердых растворов следует отличать твердые псевдорастворы подобно тому, как это различие проводят в жидких растворах.
Наконец, особо следует рассмотреть водные соединения , представления о которых за последнее время значительно уточнились.
Определенные соединения . Все определенные химические соединения, как известно, строго подчиняются закону постоянства состава, выражаемого химическими формулами, закону кратных отношений и закону паев, связывающему отношения компонентов данного соединения с отношениями их в других типах соединений. Эти законы находятся в полном соответствии с периодической системой элементов Д. И. Менделеева, законами кристаллохимии и учением о симметрии в кристаллических средах.
Характерно, что эти соединения отличаются целым рядом особых физических свойств, отчетливо выступающих на физико-химических диаграммах плавкости, растворимости, электропроводности, твердости, удельного веса, показателей преломления и пр.
К числу определенных химических соединений относятся:
- окислы (Cu 2 O, MgO, Fe 2 O 3 , SiO 2 и др.),
- различные кислородные соли (CaCO 3 , CaSO 4 , AlBO 3 , Mg 2 SiO 4 и др.),
- сульфиды (NiS, FeS 2 , Sb 2 S 3 и др.),
- галоидные соединения (NaCl, AgBr, CaF 2 и др.) и т. д.
Химический состав химических соединений может изображаться двояким способом:
- в виде эмпирических формул и
- в виде конституционных или структурных формул.
Эмпирическими формулами выражают состав минералов либо в виде элементов, входящих в соединение (например, BaSO 4 , Na 3 AlF 6 , NaAlSi 3 O 8 и т. д.), либо в виде ряда простейших составляющих соединений BaO SO 3 , 3NaF AlF 3 , Na 2 O Al 2 O 3 6SiO 2 и т. д.). Последний вид формул хотя и не отвечает современным представлениям о природе химических соединений, однако имеет то преимущество, что позволяет легче запомнить состав минералов.
Существенные поправки в начертание формул более сложных соединений вносят данные кристаллохимии, основывающиеся на рентгеноструктурном изучении минералов. Так как большинство неорганических кристаллических веществ характеризуется ионными связями структурных единиц, то в формулах химических соединений важно отражать эти структурные элементы (ионы и комплексы), устанавливаемые в различных типах кристаллических структур. Анионные комплексы в этом случае отделяются от катионов обычно квадратными скобками, например, Mg 2 , Ca 3 2 , Mg 2 , Na и т. п.
Двойные соединения . Помимо простых химических соединений, в природе распространены двойные соединения, особенно двойные соли. Двойными солями называются такие определенные соединения, которые состоят как бы из двух простых солей, присутствующих в кратных отношениях. В большинстве случаев эти соли являются двойными по катионам, реже - по анионам или одновременно по катионам и анионам. В качестве примеров могут быть приведены следующие: CaMg 2 , K 3 Na 2 и т. д.
При сравнении формул двойных солей выясняется, что входящие в их состав катионы, благодаря значительной разнице их ионных радиусов, не могут изоморфно замещать друг друга: Ca 2+ (1,01,Å) и Mg 2+ (0,75Å), K 1+ (1,33Å) и Na 1+ (0,98Å) и т. д. Поэтому не удивительно, что они от составляющих их простых солей отличаются некоторыми особенностями кристаллических структур и нередко физических свойств.
Соединения переменного состава . Кроме определенных химических соединений, существует не мало таких соединений, состав которых не является постоянным, а колеблется то в узких, то в более широких пределах, причем эти колебания состава не могут быть объяснены какими-либо механическими примесями посторонних веществ. Наоборот, колеблющийся состав соединений с кристаллохимической точки зрения находит объяснение в ограниченной растворимости составных компонентов в данном соединении. Такие химические образования получили название соединений переменного состава.
Среди минералов соединения переменного состава довольно многочисленны. В числе их прежде всего следует отметить те двойные соли, в которых составляющие их простые соли хотя и обладают аналогично построенными кристаллическими решетками, но не обнаруживают полного изоморфизма ввиду существенной разницы размеров ионных радиусов или из-за отличия поляризационных свойств. Поэтому для них характерно частичное колебание состава, выражающееся в неточном соответствии его химическим формулам со строго стехиометрическими отношениями компонентов.
В незначительных количествах изоморфные примеси других компонентов обнаруживаются в очень многих простых и сложных соединениях. К числу их относится, например, сфалерит (ZnS), в котором содержание железа в виде изоморфной примеси достигает нескольких процентов. Многочисленные другие примеры будут приведены при описании минералов.
Химические соединения переменного состава по своим свойствам не отличаются от твердых растворов и должны рассматриваться как таковые, но с ограниченной смесимостью компонентов.
Твердые растворы . Способность кристаллических веществ различного состава образовывать непрерывно меняющиеся по составу смеси одинаковой кристаллической структуры в значительной мере основана на изоморфизме, т. е. свойстве элементов заменять друг друга в химических соединениях родственного состава.
Изоморфизм двух веществ имеет место тогда, когда они обладают аналогичной химической формулой и когда у соответственных ионов обоих веществ заряды одинаковы по знаку, а размеры ионов и степень поляризации их не выходят за известные пределы, т. е. равны с известной степенью точности.
В природных условиях, например, широко распространен изовалентный изоморфизм Mg 2+ (ионный радиус равен 0,75Å) с близкими по размерам двухвалентными ионами Fe 2+ (0,79Å), Ni 2+ (0,74Å), Со 2+ (0,77Å), Zn 2+ (0,79Å) и Mn 2+ (0,91Å). Другим примером является изоморфизм трехвалентных ионов: Fe 3+ (0,67Å), Cr 3+ (0,64Å) Al 3+ (0,57Å), Mn 3+ (0,70Å), V 3+ (0,65Å), Ti 3+ (0,69Å). То же самое относится и к комплексным структурным единицам, участвующим в строении кристаллических решеток, например 2- , 2- и др.
Однако наряду с этим установлено и подтверждено экспериментально, что при образовании минералов переменного состава в кристаллических структурах может происходить замена не только простых ионов (или атомов) другими, изовалентными ионами (или атомами), но также замена целых групп ионов группами других ионов иной валентности, но с одинаковой суммой всех валентностей. Этот случай носит название гетеровалентного изоморфизма. Таков, например, изоморфизм в ряду плагиоклазов, где группа NaAlSi 3 O 8 в самых различных соотношениях может заменяться группой CaAl 2 Si 2 O 8 с образованием кристаллов одного и того же класса симметрии. В сущности, здесь мы имеем замену Na 1+ Si 4+ на Ca 2+ Al 3+ .
При гетеровалентном изоморфизме решающую роль играют все же размеры заменяющих друг друга структурных единиц (атомов, ионов, ионных комплексов): они должны быть более или менее одинаковы. Разность радиусов заменяющих друг друга компонентов, как показывают сопоставления, обычно не превышает 15% от меньшего радиуса.
Как мы знаем, ионные радиусы в вертикальных группах периодической системы элементов возрастают с увеличением порядкового номера и уменьшаются в горизонтальном направлении с увеличением номера группы (т. е. с увеличением валентности). На этом основании А. Е. Ферсманом выведен закон диагональных рядов изоморфных ионов в периодической системе элементов, справедливый для левой ее части. Намечаются следующие гетеровалентные ряды изоморфизма ионов (в скобках показаны ионные радиусы в ангстремах):
- Li 1+ (0,69)-Mg 2+ (0,75)-Sc 3+ (0,81)-Zr 4+ (0,82)
- Na 1+ (0,98)-Ca 2+ (1,01)-Y 3+ (1,06)
- К 1+ (1,33)-Sp 2+ (1,27)
- Rb 1+ (1,48)-Ba 2+ (1,36)
- Al 3+ (0,57)-Ti 4+ (0,65)-Nb 5+ (0,70)
Действительно, в природных соединениях мы нередко наблюдаем, что литиевые минералы, например, содержат изоморфные примеси магния, магниевые минералы - примеси скандия, натриевые - примеси кальция, кальциевые - примеси иттрия и т. д.
Кроме того, в комплексных анионах ион 4- может заменяться ионами 5- , 3- и 2- , обладающими одинаковыми или близкими размерами. На примерах сказанного мы не раз будем останавливаться при описании минералов.
Среди твердых растворов с генетической точки зрения важно различать два типа:
- истинные твердые растворы и
- твердые псевдорастворы.
Истинные твердые растворы , или, как их иначе называют, изоморфные смеси*, представляют собой совершенно однородные по кристаллической структуре смеси в любых пропорциях двух или нескольких веществ, не образующих химических соединений. Примерами могут служить твердые растворы золота и серебра, вольфраматов марганца и железа, плагиоклазы и т. д.
* (В литературе встречается также синоним "смешанные кристаллы" (в буквальном переводе с немецкого языка). Название не совсем правильное )
Физические и химические свойства твердых растворов являются аддитивными*, т. е. постепенно и закономерно изменяющимися при увеличении содержания второго компонента. Таковы, например, изменение температуры плавления, удельного веса, показателей преломления, отражательной способности, электропроводности и т. д. Изменения всех этих свойств на диаграммах выражаются в виде прямых линий (для удельных весов) или плавно изгибающихся кривых (температур плавления, оптических свойств и др.). Эти кривые для изоморфных рядов настолько характерны, что по совокупности изученных свойств какого-либо данного минерального вида по ним можно определить его состав, не прибегая к химическому анализу. Например, нетрудно определить таким путем по специальным диаграммам состав плагиоклаза, изучив его оптические свойства в шлифах под микроскопом.
* ("Аддо" - прибавляю )
Среди истинных твердых растворов различают два типа:
- а) твердые растворы замещения (или растворы первого рода) и
- б) твердые растворы внедрения (или растворы второго рода).
а) Твердые растворы замещения особенно характерны для металлов и ионных соединений. Сущность их сводится к тому, что в соединениях с аналогично построенными кристаллическими решетками атомы или ионы одного соединения замещаются другими (т. е. становятся на место других). Таковы, например, изоморфные ряды: ZnCO 3 -FeCO 3 , MnWO 4 -FeWO 4 и др.
б) Твердые растворы внедрения характеризуются тем, что второй компонент располагается только в пустотах, т. е. в промежутках между атомами или ионами, слагающими кристаллическую решетку первого компонента. Такого рода твердый раствор может иметь место лишь при условии, когда размеры атомов (ионов) обоих компонентов резко различны друг от друга. Наиболее характерным примером этого рода твердых растворов может служить раствор углерода в железе, легко возникающий при высоких температурах и распадающийся на железо и карбид железа (Fe 3 C) при медленном охлаждении.
В химических формулах твердых растворов изоморфные атомы или ионы ставят в круглые скобки, отделяя друг от друга запятыми и располагая их в убывающем порядке содержания: (Au,Ag), (Zn,Fe)S, (Zn,Fe)CO 3 , (Fe,Mn)WO 4 и т. д. Второстепенные изоморфные примеси либо вовсе не указываются в формуле, либо вводятся более мелким шрифтом. Если в двойной соли один из компонентов содержит изоморфные примеси, то формула изображается в следующем виде: Ca(Mg,Fe) 2 .
Твердые псевдорастворы от истинных отличаются тем, что в них содержатся тонкодисперсные примеси посторонних веществ, присутствие которых не может быть объяснено на основе законов кристаллохимии. Примерами твердых псевдорастворов могут служить кристаллозоли (стр. 39), в частности такие окрашенные полупрозрачные минералы, как розовый кварц, красный кальцит, черный сфалерит и др., кажущиеся совершенно однородными (настолько тонко распределен в них красящий пигмент).
Водные соединения . Предварительно необходимо сделать следующее важное замечание. К числу водных соединений следует относить только такие, которые в своем составе содержат электрически нейтральные молекулы воды . Раньше под видом водных соединений рассматривали также минералы, содержащие гидроксильные анионы [ОН] 1- . Однако между молекулой H 2 O и отрицательно заряженным ионом [ОН] 1- существует, естественно, принципиальная разница, весьма существенно сказывающаяся на физических и химических свойствах минералов. Гидроксил, как ион, способен заменять в соединениях такие анионы, как F 1- , Cl 1- и прочно удерживается в кристаллических решетках. Молекула H 2 O этим свойством не обладает и, будучи слабо связана в решетке, легко удаляется при нагревании. То, что гидроксил при прокаливании минералов, его содержащих, покидая кристаллическую решетку, способен превращаться в пары воды, отнюдь не может служить основанием для отождествления его с молекулой H 2 O. Поэтому весьма важно в химических формулах минералов раздельно указывать присутствие в них гидроксила и воды. С этой точки зрения, например, малахит - Cu 2 2 является не водным, а основным безводным карбонатом меди, хотя при химическом анализе гидроксил определяется в виде H 2 O. То же относится к минералам, представляющим собой кислые соли, в которых в числе катионов находится водород.
В зависимости от того, каким способом удерживается вода в минералах, различают:
- кристаллизационную или связанную воду, входящую в кристаллические решетки минералов, и
- свободную воду, не участвующую в строении самого кристаллического вещества
Связанная вода в решетке участвует в виде молекул H 2 O, занимающих в ней строго определенные места. Количество молекул воды находится в простых отношениях к другим компонентам соединения. В качестве примеров можно привести следующие: Na 2 CO 3 10H 2 O (сода), CaSO 4 2H 2 O (гипс), Ni 3 2 8H 2 O (аннабергит), Al 2 3 5H 2 O (вавеллит) и др. Это так называемые кристаллогидраты, которые, по Вернеру, должны рассматриваться как "комплексные соединения", т. е. такие, в которых молекулы воды как структурные единицы располагаются в определенной координации вокруг каких-либо ионов, создавая таким путем своего рода комплексные ионы.
Так, в кристаллической структуре соединения NiSO 4 6H 2 O рентгенометрическими исследованиями установлено, что шесть дипольных молекул H 2 O непосредственно окружают катион Ni 2+ , ориентируясь, очевидно, определенным образом по отношению к катиону (двумя протонами H 1+ к периферии комплексного иона). Так как молекула H 2 O сама по себе электрически нейтральна, то гидратированный катион 2+ сохраняет заряд Ni 2+ . Поэтому химическую формулу соединения правильнее писать тaк:.
На вопросе о причине гидратации ионов в кристаллических решетках мы остановимся позднее (во введении к кислородным солям). Здесь лишь можно указать, что необходимость гидратации ионов кристаллохимически строго оправдывается; для образования устойчивых кристаллических решеток из таких крупных по размерам анионов, как 2- , присутствующие в растворе катионы Ni 2+ слишком малы, в силу чего и возникает стремление к увеличению их объема без изменения заряда. Само собой разумеется, что образование кристаллогидратов может происходить лишь в средах, богатых водой, и при низких температурах.
При нагревании кристаллогидраты легко обезвоживаются, если не сразу целиком, то скачкообразно, периодически теряя часть молекул воды. При этом перестройка решетки происходит с сохранением рациональных отношений числа молекул H 2 O и основного соединения. Например, халькантит (CuSO 4 5H 2 О) при искусственном обезвоживании образует вначале CuSO 4 3H 2 O, затем CuSO 4 H 2 O и наконец CuSO 4 . При этом скачкообразно меняются и такие физические свойства, как показатели преломления, удельный вес и др. Из разных соединений вода удаляется при различных температурах: некоторые из них теряют ее при комнатной температуре (многоводные сульфаты меди и железа), другие - при более высоких и даже при температурах выше 100°.
Свободная вода , присутствующая в минеральных массах, характеризуется тем, что не принимает прямого участия в строении кристаллической решетки минералов. При нагревании она выделяется постепенно. Различают три вида свободной воды:
- а) цеолитную,
- б) коллоидную и
- в) гигроскопическую
Цеолитная вода получила свое название от общего названия особой группы минералов - цеолитов, в которых наиболее ярко проявлены особенности ее нахождения. Установлено, что молекулы воды в этой группе минералов не занимают какого-либо строго определенного положения в кристаллической решетке, а располагаются лишь в свободных полостях в ней (вдоль каналов, в межслоевых пространствах и пр.). Поэтому "растворимость" воды в них существенно ограничена. Интересно, что количество воды в них может меняться без нарушения кристаллической однородности вещества с постепенным изменением физических свойств: степени прозрачности, показателей преломления, удельного веса и др. Это указывает на то, что вода находится как бы в состоянии твердого раствора. При нагревании она выделяется в интервале 80-400°. Любопытно, что обезвоженные осторожным нагреванием цеолиты вновь способны поглощать воду с восстановлением прежних своих физических свойств.
Коллоидная вода, как показывает само название, распространена в гидрогелях, где удерживается на поверхности дисперсных фаз (стр. 37) очень слабыми силами связи. Она по существу является адсорбционной водой, и ее наличие не зависит от решетки адсорбента (сам адсорбент, конечно, может содержать кристаллохимически связанную воду). Примером может являться опал (гидрогель кремнезема) - SiO 2 aq (aq-первые две буквы латинского слова "аква" - вода). Такое обозначение коллоидной воды, принимаемое некоторыми авторами, следует признать рациональным.
Гигроскопическая (капиллярная) вода удерживается в тонких трещинках, порах и порошковатых массах силами поверхностного натяжения. В большей своей части она легко удаляется при нагревании до 100-110°. Резкой границы между капиллярной и коллоидной водой провести нельзя.
Часть I
1. Металлы в природе встречаются:
1) только в самородном виде Pt, Ag, Au
2) и в свободном, и в виде соединений Cu, Hg
3) только в виде соединений: большинство, а также активные М (минералы Zn, Pb, Na, Li и др.)
Обобщение этих утверждений оформите с помощью ряда активности металлов, используя фигурные скобки:
2. Минералы – это
различные природные соединения, включающие в себя М в связанном состоянии.
Заполните таблицу «Названия и формулы минералов металлов».

3. Руды – это природные образования, содержащие минералы, в которых М находятся в количествах, пригодных для получения их самих.
4. Металлургия – это наука о методах и процессах производства металлов из руд и других металлосодержащих продуктов.
5. Заполните таблицу «Классификация общих способов получения металлов».

Часть II
1. Отделение пустой породы от руды – это обогащение.
2. Заполните таблицу «Восстановители в пирометаллургии».

3. Дополните схему:

Это пример электрометаллургии.
4. Сырьём для получения алюминия являются:
а) алюмосиликаты
б) боксит, корунд
в) оксид алюминия.
5. Нарисуйте и опишите схему электролитического получения алюминия.
Процесс получения алюминия электролизом проводят в электролитических ваннах в присутствии расплавленного криолита; из оксида алюминия;
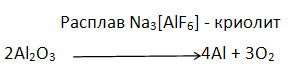
6. Напишите синквейн о металлургии.
1) Металлы
2) Способ получения
3) Пиро-, электро-, гидрометаллургия
4) Основа промышленности
5) Получение.
7. Нарисуйте и опишите схему доменного процесса.
Сущность доменного процесса состоит в восстановлении железа из оксидов и получении науглероженного металла (чугуна) и шлака, которые легко отделяются друг от друга из-за различия в плотностях.

Полученное в результате реакции железо каплями стекает по раскаленному коксу вниз, насыщаясь углеродом, в результате чего получается сплав, содержащий 2,14 – 6,67 % углерода (чугун). Кроме углерода в него входят небольшая доля кремния и марганца. В количестве десятых долей процента в состав чугуна входят также вредные примеси - сера и фосфор. Кроме чугуна в горне образуется и накапливается шлак, в котором собираются все вредные примеси.
Для выяснения химического состава минерала производят его химический анализ и определяют химическую формулу минерала. Формулы могут быть эмпирическими, показывающими только химический состав, и структурными, дающими представление о пространственном расположении атомов в минерале и их связь между собой. Для некоторых минералов структурные формулы ещё не установлены. Но благодаря рентгеновским методам исследования во многих случаях удалось определить взаимоотношения атомов в кристаллических структурах минералов. Этими вопросами связи химизма со строением вещества и его свойствами занимается кристаллохимия.
В минералах важно выявить катионы и анионные комплексы, характеризующие типы кристаллических структур. При написании формул минералов анионные комплексы отделяют от катионов квадратными скобками, например, сидерит Fe. Следует иметь в виду, что эмпирические формулы минералов не отображают особенностей их внутреннего строения и в минералогии они в настоящее время заменены структурными формулами. Так, эмпирическая формула минерала мусковита H 2 KAl 3 Si 3 O 12 , а структурная KAl 2 (OH,F) 2 . Последняя показывает, что в структуре мусковита имеется сложный анионный комплекс и что вода в мусковите находится не в виде H 2 O, а в виде гидроксила (OH) - , причём этот гидроксил может быть в свою очередь замещён F - .
В минералогии нередко различают безводные и водные минералы (сульфаты, фосфаты, карбонаты и др.). К водным относятся те минералы, которые имеют в своём составе электрически нейтральные молекулы воды. Вода в составе минералов может быть связанной и свободной. Связанная, или кристаллизационная, вода входит в кристаллическую решётку минералов, занимая в ней определённые места. Примерами могут быть некоторые карбонаты и сульфаты, например гипс. Свободная вода не участвует в строении кристаллической решётки минералов, количество её может быть различным в зависимости, например, от температуры. Примерами свободной воды является вода цеолитов. И, конечно, вся гигроскопическая вода, удерживающаяся в микроскопических трещинах минералов и пород силами поверхностного натяжения, также является свободной. Она удаляется при нагревании до 110°С. Гидроксилсодержащие минералы в строгом смысле не могут быть названы водными. Между электрически нейтральной молекулой воды H 2 O и отрицательно заряженным ионом гидроксила (HO) - существует принципиальная разница. Гидроксил (HO) - может замещать в минералах такие ионы как Cl - и Fe - , он прочно удерживается в кристаллических решётках, а молекулы воды этими свойствами не обладают.
Задание 3. Изучение форм природных выделений минералов.
Морфология минералов и агрегатов. Двойниковые
Сростки кристаллов
Для некоторых минералов (полевые шпаты, рутил, касситерит, арагонит, киноварь и многие другие) характерно образование не только одиночных кристаллов, но и их двойниковых сростков – двойников. В настоящих, не случайных, сростках, индивиды срастаются по одинаковым плоским сеткам их пространственных решеток. Геометрически индивиды в двойнике можно мысленно совместить друг с другом либо отражением в плоскости симметрии либо поворотом вокруг оси L 2 . Двойники могут состоять из пары кристаллов (простые) или из многократно повторяющихся индивидов. Характерной особенностью огранки двойников являются входящие углы между гранями; на одиночных идеально развитых кристаллах таких углов не бывает. Следует различать двойники срастания и двойники прорастания. В первых индивиды разграничены по плоскости, они как бы соприкасаются друг с другом. Во вторых кристаллы как бы обрастают друг друга либо насквозь проникают один в другой, соприкасаясь по сложной извилистой (ступенчатой) поверхности. Двойники образуются по разным причинам. В растворе, когда кристаллы находятся еще в зародышевом состоянии и под действием тех или иных сил разворачиваются относительно друг друга. При переходе одной полиморфной модификации в другую. При механических воздействиях на растущие кристаллы.
Ложные кристаллы –псевдоморфозы
Псевдоморфоза – это кристалл или зерно минерала, замещенного без изменения его формы другим минералом или смесью минералов, отсюда и название фальшивая (псевдо) форма (морфа). У этих образований сохраняются часто даже мельчайшие детали поверхности первоначальных кристаллов и зерен (рис. 27).
Рис. 27. Кварц по прожилкам асбеста:
т.наз. "Тигровый глаз" – жёлтый и "Соколиный глаз" – синий
По псевдоморфозам можно судить о химических реакциях минералообразования, так как виден одновременно и исходный минерал (зерно) и конечный продукт преобразования. Кристаллы пирита в поверхностных условиях замещаются лимонитом – плотной коричневой порошковатой массой, смесью различных гидроксидов Fe 3+ (рис. 28).

Рис. 28. Псевдоморфоза лимонита по конкреции пирита, 4см,
"Белая Пустыня", Египет
Еще один способ образования псевдоморфоз – полиморфные превращения веществ при изменении температуры и давления, они называются параморфозы. Например, параморфозы альфа-кварца по бета-кварцу (t превращения 575 0 С при 100 кПа). Бывают также пустотелые псевдоморфозы отпечатки в горной массе кристаллов растворившихся минералов, место которых осталось незанятым (рис. 29).

Рис. 29. Кварц по Флюориту
Частичное псевдоморфное замещение поверхности с последующим обрастанием замещённых участков кристаллами кварца. Сам флюорит впоследствии был растворён, оставив после себя центральные полости в форме отрицательного куба. Образец 9см, Кадамджай, Кыргызстан.
В природе относительно редко встречаются отдельные хорошо ограненные кристаллы, чаще минералы образуют различные скопления – агрегаты. В минералогии их принято подразделять по морфологии: землистые, зернистые, плотные, агрегаты; друзы, щетки, секреции, конкреции, оолиты, сферолиты, натечные агрегаты, дендриты, налеты и примазки.
Землистые агрегаты – мучнистые агрегаты очень тонких минеральных зерен. Этот тип агрегатов представлен в земной коре наиболее широко. Зернистые агрегаты это рыхлые или сплошные массы произвольно сросшихся зерен одного (мономинеральные) или нескольких (полиминеральные) минералов. Каждое зерно – не огранившийся, не оформившийся кристалл, выросший в стесненных условиях. В зависимости от размера зерен они разделяются на крупнозернистые (>5 мм), среднезернистые (1–5 мм), мелкозернистые (<1 мм). Характерный пример – полнокристаллические магматические породы (граниты и пр.).

Рис. 30. Среднезернистый агрегат амазонитового гранита
Среди минералов выделяет три группы, обладающие характерным обликом кристаллов:
– изометрические, одинаково развитые по всем трем направлениям, – магнетит, пирит, гранат;
– удлиненные в одном направлении, призматические, столбчатые, игольчатые и лучистые, – барит, кварц;
– вытянутые в двух направлениях, таблитчатые, пластинчатые, листоватые и чешуйчатые, – хлорит и др.
В соответствии с обликом кристаллов формируются различные виды минеральных агрегатов: листовые (а), чешуйчатые (б), волокнистые (в) и (г), радиально-лучистые (д), шестоватые (е) (рис. 31).
а  б
б

в
 г
г
д
 е
е

Рис. 31. Листоватый агрегат - тальк (а ), среднечешуйчатый агрегат - парагонит (б ), длинноволокнистый агрегат - хризотил асбест (в ), радиально-лучистый агрегат - эгирин (г), шестоватый агрегат - кианит (д), волокнитый агрегат – гипс селенит (е)
Параллельно-шестоватые (рис. 31, е ) и волокнистые агрегаты (рис. 31 в , г ) обычно образуются в трещинах. Это – жилки шелковистого гипса, серпентин-асбеста, шестоватого кальцита. В одних случаях эти агрегаты кристаллизуются в открытых трещинах: сначала на стенках по принципу геометрического отбора нарастают друзы; разрастаясь навстречу друг другу они смыкаются и образуют параллельно-шестоватые или волокнистые агрегаты. В других – такие агрегаты формируются в постепенно приоткрывающихся трещинах, когда скорость приоткрывания меньше или равна скорости роста индивидов. Сначала трещина заполняется зернистым агрегатом минерала в виде сплошной тонкой жилки. Затем, по мере открывания зерна, упираясь друг в друга, могут расти только вслед за раздвигающимися стенками трещины. Они постепенно вытягиваются нормально стенкам, формируя параллельно-шестоватый или волокнистый агрегат.
Натечные агрегаты
Натечные формы минеральных образований возникают за счет коллоидных растворов – гелей. Медленно мигрирующие коллоидные растворы, попадая в пустоты, обволакивают их стенки, постепенно теряют воду и густеют. В результате образуются разные формы агрегатов:
– сталактиты – свисающие под действием силы тяжести с верхних частей пустот;
– сталагмиты – образующиеся в нижних частях пустот за счет падающих капель;
– почковидные агрегаты – наиболее распространенные среди натечных форм, возникают в поверхностных условиях.
Размеры подобных образований различны: от микроскопических до крупных столбообразных натеков в пещерах. В натечных формах могут встречаться самые разные минералы: гидроксиды железа и марганца, опал, малахит, гипс, арагонит, кальцит, и др. Натечные образования в поперечном срезе имеют зонально-концентричес-кое строение.
Друзы (щетки) – группы кристаллов, наросших перпендикулярно или почти перпендикулярно к поверхности трещин, стенки жилы или полости в горной породе. Сначала нарастают одиночные кристаллы, разрастаясь, они соприкасаются друг с другом, упираются друг в друга и сами себе мешают расти. Продолжают расти только те кристаллы, вектор роста которых ориентирован в сторону свободного пространства, т.е. по нормали к поверхности трещины. Образцы друз представлены на рис. 32 а и б .
а
 б
б

Рис. 32. Друза кварца (а ), щётка кристаллов аметиста (б )
Секреции образуются, когда какая-либо полость в горной породе заполняется минеральным веществом. Часто в центре секреций располагаются друзы. Чаще всего секреции халцедона с друзами кварца внутри, приуроченные к миндалинам в базальте. Секреции с внутренними полостями называются жеоды (рис. 33).

Рис. 33. Темно-бурый халцедоновый агат с кварцевой друзой в центре
Конкреция – шаровидный (иногда как бы сплюснутый, неправильно округленный) минеральный агрегат радиально-лучистого строения (рис. 34). В противоположность секрециям (жеодам) они разрастаются вокруг какого-нибудь центра. В центре конкреции нередко находится зерно, которое служило затравкой при её росте. Чаще всего конкреции образуются в пористых осадочных породах –песках и глинах. Размеры этих образований – от миллиметров до десятков сантиметров, а иногда даже до метра и более. Они разнообразны по форме и строению. Конкреции могут быть плотными кристаллическими (радиально-лучистые или зернистые); скрытокристаллическими (кремень); рыхлыми и землистыми (лимонито-вые, вивианитовые).
В осадочных горных породах часто встречаются конкреции пирита, марказита, кремнезёма (кварцевые, халцедоновые, кремень), карбонатов и фосфоритов. Научный и практический интерес представляют железомарганцевые конкреции, они образуются в огромных количествах на океаническом дне и рассматриваются как перспективный сырьевой ресурс будущего.
Экзотическая разновидность конкреций карбонато-глинистого состава, встречающаяся только в осадочных породах и характеризующаяся наличием многочисленных трещин усыхания внутри, носит название септария (рис. 35).
. 
Рис. 34. Конкреция Рис. 35. Септария
Оолиты – шаровидные или эллипсоидальные образования из карбоната кальция, окислов железа и марганца, кремнезёма и пр., обладающие концентрически-скорлуповатым, иногда радиально-лучистым строением (вокруг центрального ядра). Ядром могут быть обломки раковин, песчинки, камешки и пр. В виде оолитов часто встречаются такие минералы как: кальцит, арагонит, пиролюзит.
Оолиты образуются в процессе осадконакопления (во взвешенном состоянии, в воде), при диагенезе и во время других стадий преобразования осадков при циркуляции растворов в пустотах. Наиболее часто оолиты формируются в горячих источниках, в придонных озерных и морских илах.
Они часто встречаются в известняках, железных рудах, бокситах (рис. 36), кремнистых породах и др. Размеры оолитов – от миллиметров до нескольких сантиметров. Оолиты крупнее 2–5 мм называются пизолитами.

Рис. 36. Боксит оолитовый
Сферолиты и почковидные агрегаты названы так по своей морфологии. Сферолиты очень часто имеют почти правильную шаровидную форму и размер от долей до 1–2 см и более. Они как шарики нарастают на другие минералы и на стенки разных пустот в рудах и горных породах. Сферолиты образуются либо как результат расщепленного роста кристаллов, либо в них, как в конкреции, есть ядрышко-зерно, на которое нарастает минерал. Вследствие геометрического отбора или стесненных условий кристаллы могут разрастаться, только расходясь лучами от центра сферолита (рис. 37).
Рис. 37. Сферолит
Почковидные агрегаты состоят из множества соприкасающихся "почек", каждая из которых имеет, подобно сферолиту, радиально-лучистое строение (рис. 38). Особенно типичное строение имеют почковидные агрегаты гётита HFeO 2 H 2 O и малахита Cu 2 (CO 3)(OH) 2 . Их образование происходило на неровной поверхности за счет группового роста и геометрического отбора сферолитов; оставались и разрастались только те сферолиты, которые находились на выпуклостях субстрата. Наиболее часто почковидные агрегаты образуются в различных пустотах в приповерхностных зонах разрушения и выветривания руд и горных пород.

Рис. 38. Почковидный агрегат гематита радиально-лучистого
Дендриты представляют собой фигуры в виде ветвей дерева, образующиеся благодаря быстрому росту кристаллов по некоторым направлениям. Встречаются на поверхности пород вдоль тонких трещин. Дендриты особенно характерны для окислов марганца (рис. 39).

Рис. 39. Дендриты окислов марганца (вернадит) на сиените
Землистые массы представляют собой мягкие мучнистые скрытозернистые образования. Часто наблюдаются в виде корок и скоплений, возникающих чаще всего при химическом выветривании горных пород и руд. В зависимости от цвета землистые массы называют сажистыми (черные массы гидроксидов марганца), охристыми (желто-бурые массы гидроксидов железа).
ПОНЯТИЕ О МИНЕРАЛЕ И МИНЕРАЛОГИИ
Минералы - это природные вещества (химические соединения, реже элементы) с определенными химическими и физическими свойствами. Слово «минерал» означает рудный штуф, кусок руды.
Горную породу, например, гранит, также продукт геологических процессов в земной коре, нельзя назвать минералом, так как она неоднородна физически и химически в разных частях. Гранит включает в себя как кварц со своим составом и строением, так и полевой шпат, слюду, отличающиеся от кварца и друг от друга.
Минералогия - наука, изучающая минералы. Современная, минералогия изучает происхождение (генезис) минералов, закономерности их распространения в природе (парагенезис), а также условия превращения их в другие минералы, так как каждый из минералов образуется и устойчив в определенном интервале температуры, давления и концентрации химических элементов. В задачу минералогии входит также изучение морфологии (внешнего вида), физических свойств, химического состава и внутренней структуры минералов.
Минералы имеют важное значение в народном хозяйстве: их используют в качестве строительных материалов, драгоценных и полудрагоценных камней, руд черных, цветных и редких металлов, агроруд и др.
Поиски их рациональны лишь на основе знания законов образования минералов в определенной природной обстановке.
Минералогия тесно связана со всем циклом геологических наук: геологией, петрографией и геохимией, учением о полезных ископаемых. Связана минералогия и с циклом физико-химических наук: химией, физикой, кристаллографией.
Земная кора состоит из минералов. Известно их около 2000. Большая часть минералов в природе находится в твердом состоянии; известны также жидкие минералы (ртуть, вода, нефть и др.) и газообразные (углекислый газ, горючие газы, сероводород, сернистый газ и др.).
Люди уже давно научились создавать синтетические продукты, близкие по свойствам, составу и структуре к минералам. Их называют искусственными минералами (например, кварц, корунд, слюда и др.).
Названия минералов даются по характерным физическим свойствам (например, магнетит), по химическому составу (серный колчедан) или по месту первого обнаружения (Лабрадор по названию полуострова Лабрадор в Северной Америке), в честь ученых или общественных деятелей (биотит - черная слюда, в честь физика Био). Большинство минералов имеет несколько названий.
^
ХИМИЧЕСКИЙ СОСТАВ И ФОРМУЛЫ МИНЕРАЛОВ
Состав минерала определяют при помощи химического анализа в лаборатории. Вначале выявляют содержание окислов или отдельных элементов в процентах, затем полученные данные выражают химической формулой минерала.
Например, химический анализ медного колчедана (халькопирита) дает такой состав: Fе = 30,27%; Сu= 34,98%; S = 35,75%.
Для определения химической формулы надо цифры, полученные при анализе, разделить на соответствующие атомные или молекулярные веса. Далее атомные или молекулярные количества элементов или окислов сравнивают между собой и находят их кратные отношения. Они служат коэффициентами в химической формуле минерала (табл. 3).
Таблица 3.
Пример определения формулы халькопирита
| Химические элементы | Кол-во вещества, % | Атомные количества | Отношение между атомными количеcтвами | Формула |
| Fе | 30,27 | 1 | СuFеS 2 |
|
| Сu | 34,98 |  | 1 |
|
| S | 35,75 |  | 2 |
Формула халькопирита выражает его количественный состав, но не дает представления о сочетаниях и способах связи между элементами. Коэффициенты в химической формуле показывают лишь, в каком отношении находятся между собой элементы, входящие в состав этого минерала.
Наряду с эмпирическими химическими формулами используются также структурные формулы, которые дают представление не только о химическом составе, но и пространственном положении
атомов в минерале и их связи между собой. Например, эмпирическая формула минерала малахита Н 2 Сu 2 СO 5 , а структурная, изображенная на плоскости:
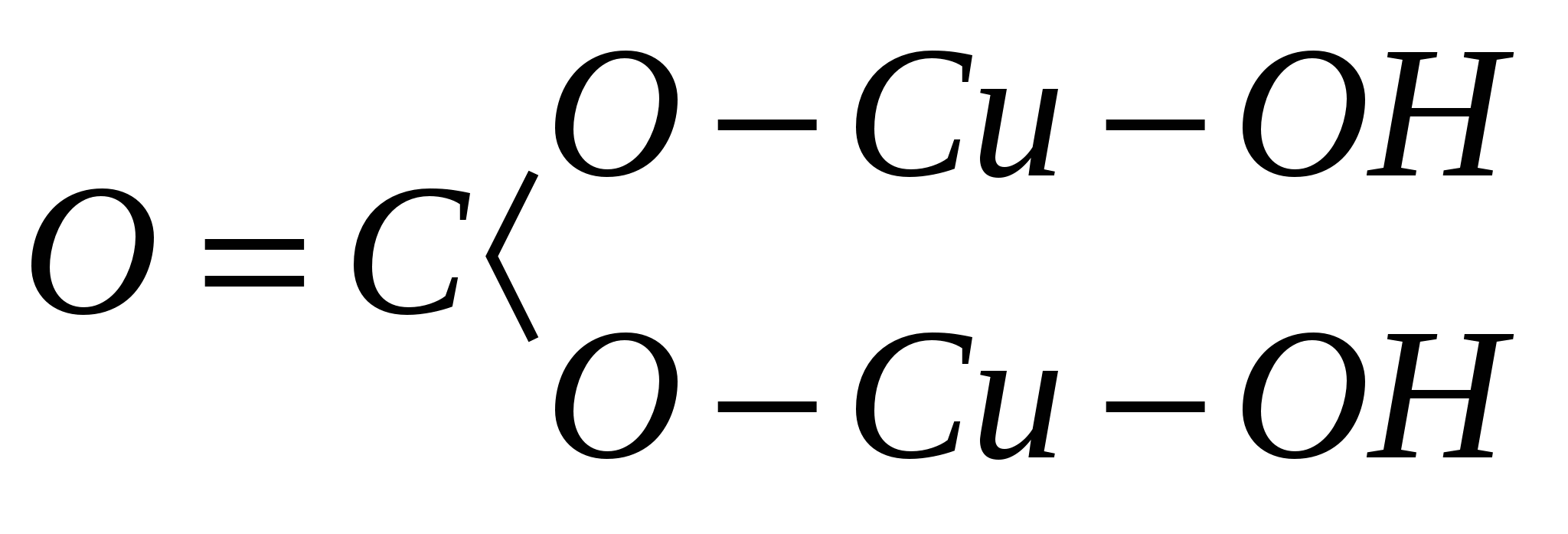
С учетом сказанного приведенную выше формулу минерала малахита можно написать в следующем виде: Сu 2 (ОН) 2 СО 3 . Из этой основанной на структурном принципе формулы следует, что вода связана с медью прочно, не в виде Н 2 О, а в виде гидроксила (ОН) 1- .
Рентгеновский метод дает возможность выявить связи между атомами в кристаллических структурах минералов, а иногда также расположение последних в пространстве. Вопросами связи химизма со строением вещества и его свойствами занимается наука кристаллохимия.
В настоящее время применяется много способов написания химических формул минералов в зависимости от того, что именно хотят передать формулой. Например, структурная формула ортоклаза К[(АlSi 3)О 8 ] характеризует тип химического соединения и взаимные связи между отдельными элементами. Для отражения качественного состава важнейших компонентов (элементов) и их количественных соотношений следует формулу ортоклаза представить в виде окислов К 2 О А1 2 O 3 -6Si0 2 .
Химический состав большинства минералов нельзя точно выразить формулой. Это зависит от различных механических примесей в минералах и от способности некоторых соединений образовывать изоморфные смеси или твердые растворы.
Примеси могут быть либо механическими, грубыми, легко отделяемыми, либо очень тонкими, отделяющимися с большим трудом. Появление примесей происходит в связи с захватом растущим минералом постороннего вещества. Наличие обычных грубых примесей не отражается на формуле минерала.
Изоморфизм (от греч. «изос» - равный и «морфэ» - форма) - это способность веществ, близких по химическому составу и кристаллографическим свойствам, давать смешанные кристаллы, т.е. строить общую кристаллическую решетку при кристаллизации из расплавов или растворов. Такие кристаллы называются изоморфными смесями. Они имеют переменный состав; иначе их называют твердыми растворами.
С точки зрения химизма и строения кристаллической решетки различают два главных вида изоморфизма: изовалентный и гетеровалентный.
При изовалентном изоморфизме взаимозамещающие ионы имеют одинаковую валентность, в кристаллической решетке происходит замена частиц одинаковой валентности - одного иона другим. Это наиболее простой случай образования смешанных кристаллов. Химические формулы изоморфных веществ в этом случае совершенно подобны, отличаясь лишь одним ионом, обычно катионом, как, например, в оливинах. Оливины, кристаллизующиеся в ромбической сингонии, представляют собой изоморфную смесь двух веществ: форстерита Мg 2 и фаялита Fе 2 , которые встречаются и в виде самостоятельных минералов (также ромбической сингонии); формула оливинов имеет вид: (Мg, Fе) 2 . Запятая между ионами Мg 2+ и Fе 2+ в этой формуле означает, что они могут замещать друг друга в любых количествах, образуя непрерывный ряд соединений промежуточного состава. На первое место обычно ставится преобладающий элемент.
Гетеровалентный изоморфизм более сложный: в кристаллической решетке происходит замена ионов разной валентности, но электростатический баланс восстанавливается так, что сумма валентности замещающих пар равна. Классическим примером такого сложного замещения являются минералы из группы полевых шпатов - плагиоклазы. Плагиоклазы представляют собой непрерывный изоморфный ряд минералов, кристаллизующихся в три-клинной сингонии, где пара ионов Са 2+ А1 3+ замещается парой Na + Si 4+ . Крайние члены этого ряда - анортит Са [(А1 2 Si 2)О 8 ] и альбит Nа [(А151 3)О 8 ] - встречаются также и в виде самостоятельных минералов. В данном случае имеется одинаковая суммарная валентность замещающих групп (5 и 5); при вычитании NaSi из формулы альбита и СаА1 из формулы анортита для обеих формул остаток одинаков - АlSi 2 О 8 .
В соответствии с изменением состава изменяются и физические свойства изоморфных веществ. Например, у плагиоклазов изменяются оптические свойства, на чем основана их диагностика при кристаллооптическом изучении. У оливинов изменяется окраска минерала от зеленой до черной, а также понижается температура плавления с повышением содержания фаялита.
По степени совершенства изоморфных замещений можно выделить два случая. В первом случае замещение одного элемента другим может быть в пределах до 100% - это совершенный, или полный, изоморфизм (оливины, плагиоклазы). Во втором случае замещение может быть частичным - от сотых долей до нескольких процентов. Это несовершенный, или ограниченный, изоморфизм. Так, кальцит Са [СО 3 ] и магнезит Мg [СО 3 ] дают лишь одно соединение промежуточного состава - доломит СаМg [СО 3 ] 2 . Отсутствие в формуле доломита запятой между Са и Мg указывает на то, что здесь мы имеем химическое соединение определенного состава, а не изоморфную смесь.
Элементы, способные замещать друг друга в узлах кристаллической решетки (занимать в ней одинаковое положение) без нарушения ее строения, называются изоморфными между собой и относятся к одному изоморфному ряду. Понятие об изоморфных рядах элементов, связанных с периодической системой Менделеева, было разработано академиком В.И.Вернадским. В разных термодинамических оболочках земной коры эти изоморфные ряды различны, т.е. изменяются под влиянием температуры и давления. Почему же атомы или ионы данного элемента могут замещать в кристаллической решетке атомы (ионы) только некоторых, а не всех элементов? Чтобы это понять, попытайтесь представить себе кристаллическую решетку не как систему точек, разделенных большими пустыми промежутками (как обычно изображается пространственная решетка), а как систему соприкасающихся шаров. Каждый шар - сфера действия атома (иона), т. е. пространство, внутрь которого не могут в соответствии с законами взаимодействия электрических зарядов проникнуть другие атомы (ионы), окруженные своими атомными (ионными) сферами.
Таким образом, расстояния между определенными атомами (ионами) решетки при определенных условиях температуры и давления строго постоянны и определяются законами электростатики. Постоянны и радиусы сфер действия атомов (ионов), называемые атомными (ионными) радиусами (R i ) 1 .
Измерение атомных и ионных радиусов показало, что между собой изоморфны только те элементы, атомные (ионные) радиусы которых близки между собой. Разница в размерах радиусов взаимно замещающих ионов не должна превышать 15% от радиуса меньшего из ионов.
Поясним сказанное примерами. Непрерывный изоморфный ряд известен для карбонатов магнезита Мg [СО 3 ] и сидерита Fе [С0 3 ] вследствие большой близости атомных (ионных) радиусов магния и закисного железа: R i Мg 2+ =0,74Å; R i Ре 2+ =0,80Å. Члены этого ряда могут быть выражены формулой (Мg, Fе) [СО 3 ] или (Fе, Мg) [СО 3 ]; здесь запятая показывает, что ионы Мg и Fе ведут себя подобно атомам одного элемента. А вот у галита NаС1 и сильвина КС1, кристаллизующихся в кубической сингонии, при аналогии химического состава изоморфных отношений не наблюдается (при обыкновенной температуре), так как размеры их ионных радиусов сильно отличаются (R i Ма + = 0,98 Å, а R i K + = 1,33 Å).
Явление изоморфных замещений не остается неизменным при различных внешних условиях. При высоких температурах замещение идет легче, и многие вещества, не изоморфные при обычной температуре, становятся изоморфными при высоких температурах. Так, например, щелочные полевые шпаты, ортоклазы К [(А1Si 3)О 8 ] и альбит Na [(А1Si 3)О 8 ] при кристаллизации из магмы образуют непрерывный изоморфный ряд (К, Na) [(А1Si 3)0 8 ], но затем при понижении температуры эта изоморфная смесь вновь распадается в твердом состоянии на два самостоятельных минерала: один с преобладающим содержанием калия - ортоклаз и другой с преобладающим содержанием натрия - альбит. Это явление получило название распада твердых растворов.
1 Ионные (атомные) радиусы измеряются в ангстремах (Å); 1 Å = 10- 8 см.
Большинство минералов в тех или иных количествах содержит изоморфные примеси. Важнейшие и наиболее распространенные группы силикатов (оливин, пироксены, амфиболы, полевые шпаты) представляют собой изоморфные смеси.
Изоморфизм помогает понять причины многочисленных ассоциаций элементов в земной коре и дает возможность предвидеть в ряде случаев наличие тех или иных промышленно-ценных редких (рассеянных) элементов во многих широко распространенных минералах. Так, например, германий маскируется кремнием, цезий, рубидий - калием и т. д.
Полиморфизм (от греч. «поли» - много и «морфэ» - форма), или многоформность, - это способность вещества кристаллизоваться при том же химическом составе в различных структурах, относящихся к различным видам симметрии или сингониям. Отдельные разновидности одного и того же вещества, имеющие разное строение, отличаются и по своим свойствам. Они представляют собой минералы - полиморфные разновидности (модификации) данного вещества. Возникновение таковых объясняется различными физико-химическими условиями их образования (температуры, давления) и характером окружающей среды. Полиморфным разновидностям одного и того же химического соединения дают разные названия или же обозначают буквами греческого алфавита α, β, γ.
Классическим примером полиморфизма является углерод. Он кристаллизуется в двух системах: кубической - алмаз и гексагональной - графит. По свойствам эти два минерала резко отличаются друг от друга. Алмаз замечателен своей высокой твердостью, является самым твердым из всех известных нам минералов, не проводит электричество. Бесцветные и прозрачные кристаллы его имеют необычайно сильный блеск.
Совершенно другими свойствами обладает графит. Твердость его небольшая (графитовые карандаши), легко расщепляется на чешуйки, хорошо проводит электрический ток. Агрегаты графита отличаются своей непрозрачностью и черным или стально-серым цветом.
Плотности их также резко различны: у алмаза плотность 3,5 - 3,6, у графита - 2,2.
Алмаз образуется при высокой температуре и очень высоком давлении, на большой глубине внутри Земли, графит - на меньшей глубине, при меньших температурах и давлении.
Причина различных свойств алмаза и графита объясняется их структурой, т.е. расположением атомов углерода. У графита связь атомов углерода менее прочная, чем в алмазе. Структура графита характеризуется плотным размещением атомов углерода в параллельных плоскостях (рис. 25). В каждом слое атомы расположены по углам правильных шестиугольников и между ними существует прочная связь. По вертикальному направлению слои удалены друг от друга на большие расстояния, и связь между ними более слабая. Полиморфизм минералов, представляющих собой химические элементы (углерод, сера и др.), называют аллотропией. Хорошо известны гексагональная, ромбическая и моноклинная модификация серы.
В виде различных полиморфных разновидностей встречаются и более сложные образования: CaCO 3 , FeS 2 и др.
Переход одной полиморфной разновидности (модификации) в другую, вызываемый, например, изменением температуры, происходит скачком, с перестройкой структуры при определённой, характерной для данной разновидности (если давление остаётся неизменным) и сопровождается выделением или поглощением тепла.
Хорошо изучен полиформизм кремнезема (SiO 2), который образует три основные разновидности: кварц, тридимит и кристобалит, каждая из которых имеет несколько модификций. При повышении температура кварц, устойчивый только до 573°С, переходит последовательно в целый ряд полиморфных модификаций:
Знание температур полиморфных преобразований кварца используется для практических целей (например, для получения тридимита – огнеупорного материала, который не испытывает превращений в интервале температур 870-1470°С, кварц предварительно нагревают до температуры выше 870°С).
Наличие полиморфных модификаций у кремнезема позволяет использовать его и в качестве геологического «термометра». По нахождению той или иной полиморфной модификации среди горных пород и жильных месторождений мы можем судить о температурных интервалах, в которых происходило образование породы.
Для образования полиморфной разновидности того или иного вещества необходимы определенные интервалы значении температуры и давления. С изменением этих параметров она становится неустойчивой и теоретически со временем должна перейти в разновидность, устойчивую в новых условиях. Но вследствие очень малой скорости перестройки кристаллической решетки при низких температурах полиморфные разновидности одного вещества могут существовать в одних и тех же условиях практически бесконечно долго: одна - в устойчивом состоянии, другая - в относительно неустойчивом (например, алмаз на поверхности земли).
Каждый минерал характеризуется определенным химическим составом. могут состоять либо из одного химического элемента, либо из нескольких. Если минерал состоит из одного химического элемента, его называют самородным элементом. Например, самород-ное , самородное серебро, самородная и т. д. Однако большинство минералов состоит из нескольких, а иногда и многих химических элементов. Состав минералов принято выражать в виде химической формулы или в весовых процентах, определяемых с помощью химического анализа.
Например, химический состав минералов халькопирита и анальцима может быть выражен следующими весовыми процентами химических элементов (для первого) или окислов (для второго):
I. (Cu — 34,9)+(Fe — 30,47)+(S — 34,6)=Сумма 99,97
II. (SiO 2 — 55,12)+(Al 2 O 3 — 22,99)+(Na 2 O — 13,53)+(H 2 O — 8,27)= Сумма 99,81
Формулы данных минералов рассчитываются делением указанных весовых количеств на соответствующие атомные или молекулярные массы. При этом получают атомные или молекулярные количества. Атомные массы химических элементов берутся по таблице периодической системы элементов Д. И. Менделеева, молекулярная масса окисла выводится путем суммирования атомных масс, слагающих соответствующий окисел элементов. Атомные или молекулярные количества заменяют пропорциональными им коэффициентами в получаемой формуле. Примеры расчета формулы халькопирита и анальцима приводятся в табл. 7.
Формулы, получаемые при расчете и дающие представление о химическом составе минерала, называются эмпирическими. Таковы полученные формулы халькопирита и анальцима - 4Si02 Аl203 NagO 2Н20. Эмпирическая формула анальцима, написанная в виде окислов, не отражает связей между химическими элементами и ничего не говорит о структуре минерала, такое написание формулы имеет одно преимущество - ее проще запомнить.
| Пересчёт данных химического анализа и установление формулы минерала Таблица 7 | ||||
| Компоненты | Весовые проценты | Атомные(молекулярные)количества | Отношения между атомами (молекулярными)количествами | Название и формула минерала |
| Cu | 34,9 | 34,9: 63,5 = 0,550 | 1 | CuFeS2 |
| Fe | 30,47 | 30,47: 55,8 = 0,546 | 1 | |
| S | 34,6 | 34,6: 32 = 1,081 | 2 | |
| SiO2 | 55,12 | 55,12: 60 = 0,919 | 4 | 4SiO2 · Al2O3 · Na2O · 2H2O |
| Al2O3 | 22,99 | 22,99: 102 = 0,225 | 1 | |
| Na2O | 13,53 | 13,53: 62 = 0,218 | 1 | |
| H2O | 8,27 | 8,27: 18 = 0,459 | 2 | |
Для ряда минералов принято писать формулы, в которых отражается тип химического соединения и взаимные связи между слагающими химическими элементами. Такие формулы называются структурными или кристаллехимическими. Формула анальцима Na H 2 O; является структурной. Квадратными скобками выделен радикал, представляющий сложный анионный комплекс , имеющаяся в минерале в количестве одной молекулы, пишется в конце формулы и отделяется от нее точкой. Другой пример. Эмпирическая формула мусковита H 2 KAl 3 Si 3 O 12 , структурная - KAl 2 (OH, F) 2 . В данной формуле выделен в виде радикала сложный анионный комплекс, а присутствует в минерале не в виде Н 2 O, а в виде гидроксила (ОН) — , который может замещаться Как уже отмечалось, изоморфные примеси в формуле минерала изображаются в круглых скобках и отделяются друг от друга запятой. Химический элемент, стоящий на первом месте в скобках, присутствует в большем количестве. Например, формула анкерита Са (Mg, Fe) 2 2 . Рентгеноструктурный анализ в настоящее время позволил установить структурные формулы многих минералов.
