Индикатор pH . Цвет индикатора
Известны несколько сот кислотно-основных индикаторов , искусственно синтезированных начиная с середины XIX в. С некоторыми из них можно познакомиться в школьной химической лаборатории. Индикатор pH метиловый оранжевый (метилоранж) в кислой среде красный, в нейтральной - оранжевый, а в щелочной - жёлтый. Более яркая цветовая гамма свойственна индикатору тимоловому синему: в кислой среде он малиново-красный, в нейтральной - жёлтый, а в щелочной - синий. Индикатор pH фенолфталеин (он продаётся в аптеке под названием «пурген») в кислой и нейтральной среде бесцветен. Цвет индикатора в щелочной среде имеет малиновую окраску. Поэтому фенолфталеин используют лишь для определения щелочной среды. В зависимости от кислотности среды изменяет окраску и краситель бриллиантовый зелёный (его спиртовой раствор используется как дезинфицирующее средство - «зелёнка»). Для того чтобы проверить это, надо приготовить разбавленный раствор бриллиантового зелёного: налить в пробирку несколько миллилитров воды и добавить в неё одну-две капли аптечного препарата. Раствор приобретёт красивый зелёно-голубой цвет. В сильнокислой среде его окраска сменится жёлтой, а в сильнощелочной среде - цвет индикатора исчезнет (раствор станет прозрачным).
Однако наиболее часто в лабораторной практике используется универсальный индикатор pH - смесь нескольких кислотно-основных индикаторов.
Как сделать индикатор рН
Как сделать индикатор рН ? Поступим таким образом.
Некоторые вещества, используемые нами в пищу, превосходно заменяют индикатор pH , применяемый в химических лабораториях.
1 СПОСОБ: Как сделать индикатор рН из сока чёрной смородины
Нарежьте тонкие лоскутки бумаги (1 х 5 см вполне подойдут), - бумага должна быть белая. Опустите несколько лоскутков бумаги в свежий сок смородины, - пусть полежат минут 5-6, пропитаются. Затем надо извлечь их из сока и дать высохнуть. Когда высохнет - индикатор pH будет готов. Опробуем его действие. Для этого опустим наш один индикатор pH в раствор кальцинированной соды, который вероятно имеется в хозяйстве (или продаётся в хозяйственных магазинах). Можно также использовать нашатырный спирт. Наш индикатор pH среагирует на раствор и изменит свой цвет на сине-зёлёную (ведь растворы кальцинированной соды и нашатырного спирта дают щелочную среду!). А теперь возьмите новый индикатор pH и капните на него уксусом или лимонным соком. Окраска измениться на ярко красную!
* Кальцинированная сода (или карбонат натрия)– Na 2 CO 3 – белый порошок, применяемый в бытовом хозяйстве для чистки и мойки в качестве сильного отмывающего средства. Это средство прекрасно растворяется в воде, образуя при этом сильную щелочную среду. Раствор кальцинированной соды при кипячении очищает даже посуду со следами подгоревшей пищи. Голыми руками работать с раствором нельзя из-за большой химической активности.
Персоль
. Это сложное вещество - соль, главная составная часть которой - связанный карбонат натрия и перекись водорода в одной молекуле 2Na 2 CO 3 *3H 2 O 2 . Химическое название этого сложного вещества - пероксокарбонат натрия - комплексная соль. По внешнему виду - это мелкие белые кристаллы. При нагревание это вещество легко разлагается, выделяя кислород и превращаясь в карбонат натрия (обычная стиральная сода Na 2 CO 3) и воду.
Персоль хороша тем, что практически не портит краски. С помощью персоли легко выводятся пятна от чая, кофе, фруктов, жира.
Пищевая сода (или гидрокарбонат натрия)– NaHCO 3 – очень похожа на кальцинированную соду и отличается от неё по химическому составу лишь на один атом натрия. В кальцинированной соде атомы натрия заместили все атомы водорода, а в пищевой соде – «атомов натрия не хватило». Пищевая сода не опасная для употребления.
Используют эту соду для мойки посуды, особенно хорошо эта соль отмывает коричневый налёт (дубильную кислоту), оставляемый после выпитого чая на кружках. Пищевая сода значительно хуже растворяется в воде, чем кальцинированная (стиральная)сода, и, в отличии от последней, даёт очень слабую щелочную реакцию.
2 СПОСОБ:
Точно таким же образом можно приготовить сделать индикатор рН из сока шелковицы
. Этот индикатор pH тоже прекрасно реагирует на кислоту или щёлочь. Индикатором может служить луковый отвар, но индикатор pH, изготовленный на его основе, имеет менее выраженные краски и особо не показателен.
При желании можно попробовать действие этих индикаторов на других растворах: стиральных порошках, мыле, нашатырном спирте, газированной воде и др.
Если раствор имеет выраженную среду меньше или больше 4 по шкале pH), то каждый раз наш индикатор pH будет менять свой окрас где больше, где меньше – в зависимости от активности среды.
3 СПОСОБ:
Как сделать индикатор рН из сока черноплодной рябины
. Цвет индикатора будет изменяться с фиолетового на голубой или синий в зависимости от pH раствора. Фиолетовую окраску сокам придают так называемые антоциановые красители, которые обладают свойствами индикаторов. В присутствии кислот они фиолетовые, а в нейтральной или щелочной среде - синие. Если несколько капель сока черноплодной рябины растворить в стакане с раствором соды, то она приобретёт синюю окраску. Наш индикатор pH будет фиолетовым, если его поместить в кислую среду (например уксус или лимонную кислоту).
4 СПОСОБ
Как сделать индикатор рН из цветной капусты
. Потрите кусочек краснокачанной капусты на тёрке. Затем положите тёртую капусту в какую-нибудь посуду и наполовину заполните посуду водой. В течении 20-30 с прогрейте контейнер с капустой и водой. Вода должна стать горячей и приобрести темно-пурпурный цвет.
Встряхните посуду, перелейте пурпурную жидкость в кружку, при этом оставьте кусочки капусту в посудине. Всё индикатор pH готов.
Разлейте раствор в несколько мелких колбочек и попробуйте смешать с разными веществами (лимонной кислотой, уксусом, раствором кальцинированной соды). Если среда кислая - значит индикатор изменит цвет с пурпурного на розовый, если щелочная - индикатор станет зелёным!
4"-(диметиламино)азобензол-4-сульфокислоты натриевая соль, Гелиантин, Метилоранж, международное название - Methyl Orange.
Метилоранж растворим в воде 0,2 г. на 100 г., лучше в горячей.
Переход окраски в водных растворах от красной к оранжево-жёлтой
наблюдается в области рН 3, 1 — 4, 4 (в кислой среде красный, в щелочной
— жёлтый).
На интервал перехода окраски влияют: температура, наличие в растворе
солей, органических растворителей, белковых веществ и других. Влияние
температуры наиболее значительно для индикаторов, являющихся слабыми
основаниями: например, для метилового оранжевого при комнатной
температуре окраска изменяется в пределах рН 3, 1 — 4, 4, а при 100°С — в
пределах рН 2, 5 — 3, 7. Токсичен. Метиловый оранжевый получают, диазотируя сульфаниловую кислоту, а затем сочетая полученное вещество с диметиланилином. Метиловый оранжевый, как его неправильно
называют метилоранж, является индикатором для кислоты и щелочи. В
щелочной среде он имеет желтый цвет, а в кислой — красный. Как краситель
применяется редко.
Сначала приготовьте раствор
хлористоводородного диметиланилина. Для этого растворите 3 г
диметиланилина в 15 мл воды и прибавляйте при размешивании небольшими
порциями концентрированную соляную кислоту до тех пор, пока раствор не
будет нейтрализован. Соляной кислоты (уд. вес 1,19) потребуется около
3-3,5 мл. Убедиться в том, что раствор
нейтрализован полностью, можно только при помощи фуксиновой бумажки,
которая в присутствии свободной соляной кислоты обесцвечивается.
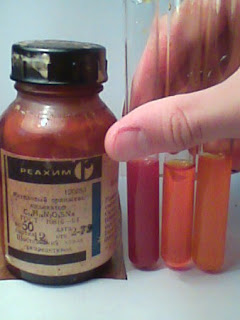
Поэтому после каждого прибавления в раствор соляной кислоты делайте пробу на фуксиновую бумажку. При отсутствии фуксина используйте бумажку, окрашенную в конго красное, которое от присутствия кислоты синеет. Когда раствор хлористоводородного диметиланилина будет готов, в колбу на 300 мл внесите 5 г просушенной на водяной бане сульфаниловой кислоты, 1,75 г безводного карбоната натрия и 75 мл воды. Смесь осторожно размешайте стеклянной палочкой с резиновым наконечником и прилейте в нее раствор чистого азотистокислого натрия (2,1 г соли в 10 мл воды). Раствор хлористого диметиланилина охладите до 0 °С и в него при постоянном помешивании влейте диазотированный раствор. Жидкость размешивайте в течение 20-30 минут и подщелачивайте раствором едкого натра до нейтральной реакции. Через некоторое время начинают выпадать оранжевые кристаллы. Для полного осаждения кристаллов метилового оранжевого раствор оставьте стоять в течение суток, после чего осадок отсосите при помощи воронки Бюхнера и водоструйного насоса или аспиратора. Готовую продукцию подсушите в сушильном шкафу при температуре 25-30 °С. Применяется в качестве кислотно-основного индикатора, титранта при определении сильных окислителей, спектрофотометрическом определении окислителей (хрома, брома). 0,1%-ный водный раствор применяется в аналитической химии как индикатор. Изменяет цвет от красного в кислотной среде (pH 3,1 до 4,4) к оранжевому в нейтральной и жёлтому в щелочной.
Источники : ресурсы Интернет.
Метиловый оранжевый
| Метиловый оранжевый | |
 |
|
 |
|
| Общие | |
|---|---|
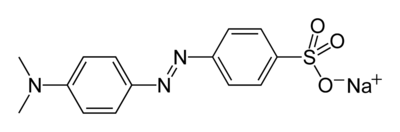
| Систематическое наименование | 4- (4 - диметиламинофенилазо) бензолсульфонат натрия |
| Традиционные названия | метилоранж |
| Химическая формула | C 14 H 14 N 3 O 3 SNa |
| Физические свойства | |
| Молярная масса | 327.3359 г/моль |
| Плотность | 1.28 г/см³ |
| Термические свойства | |
| Химические свойства | |
| Растворимость в воде | (при 50°С) 0.2 г/100 мл |
| Растворимость в этанол | нерастворим г/100 мл |
Метиловый оранжевый (метилоранж гелиантин, 4-(4-диметиламинофенилазо)бензолсульфонат натрия) - известный кислотно-основной индикатор . Метилоранж является органическим синтетическим красителем из группы азокрасителей.
Свойства
Внешний вид при обычных условиях: оранжево-жёлтые листочки или порошок, чешуйки. Метилоранж растворим в воде 0,2 г. на 100 г., лучше в горячей.
В растворах с рН 2 абсорбирует свет в λmax 505 нм.
Переход окраски в водных растворах от красной к оранжево-жёлтой наблюдается в области рН 3, 1 - 4, 4 (в кислой среде красный, в щелочной - жёлтый).
На интервал перехода окраски влияют: температура, наличие в растворе солей, органических растворителей, белковых веществ и других. Влияние температуры наиболее значительно для индикаторов, являющихся слабыми основаниями : например, для метилового оранжевого при комнатной температуре окраска изменяется в пределах рН 3, 1 - 4, 4, а при 100°С - в пределах рН 2, 5 - 3, 7.
Применение

Метиловый оранжевый
Применяется в качестве кислотно-основного индикатора, титранта при определении сильных окислителей, спектрофотометрическом определении окислителей (хрома , брома).
0,1%-ный водный раствор применяется в аналитической химии как индикатор .
Изменяет цвет от красного в кислотной среде (pH 3,1 до 4,4) к оранжевому в нейтральной и жёлтому в щелочной.
Получение
Лабораторный способ синтеза:
Метиловый оранжевый получают, диазотируя сульфаниловую кислоту, а затем сочетая полученное вещество с диметиланилином.
Методика выполнения:
Навеску сульфаниловой кислоты растворяют в 25 мл 2 М раствора едкого натра (2 г NaOH в 25 мл раствора). В этом же растворе затем растворяют навеску нитрита натрия массой 4 г. После этого раствор охлаждают льдом и приливают к 25 мл 2 М раствора соляной кислоты, охлаждаемого льдом (кроме наружного охлаждения кусочки льда могут быть помещены в раствор). Навеску диметиланилина растворяют в 5 мл 1 М соляной кислоты, охлаждают льдом и к охлажденному раствору приливают полученный выше раствор диазобензолсульфокислоты. Происходит образование красителя. Приливают еще раствор едкого натра до сильнощелочной реакции. Из раствора выделяется натриевая соль красителя в виде оранжево-коричневых лепесткообразных кристаллов. Через несколько часов краситель отфильтровывают с отсасыванием и промывают на воронке 25 мл воды. Затем его тщательно отжимают на фильтровальной бумаге и сушат в фарфоровой чашке на водяной бане.
Влияние метилового спирта на организм. Способы отличить метиловый и этиловый спирт.
У многих людей неоднозначное отношение к спирту. Кто-то регулярно употребляет спиртные напитки, а кто-то их не переносит. Существует масса альтернативных вариантов алкоголя. Сейчас на полках магазинов очень много разнообразных настоек на основе боярышника, рябины и целебных трав.
Незнающие люди могут подумать, что употреблять можно любой спирт. Но на самом деле это неправильно. Ведь не все виды спирта это алкоголь, среди спиртов очень много ядов. Не стоит принимать метиловый спирт, так как это отрава.
По вкусу и запаху отличить этиловый и метиловый спирт сложно. Они практически неотличимы и вы даже не догадаетесь, что пьете подделку. Вкус и запах такой, как у этилового спирта. Изготавливали спирт при помощи синтеза из водорода, но сейчас этот способ считается кустарным и не применяется. Наиболее дешевым можно считать производство из отходов нефтепродуктов.

В основном метанол применяют в химической промышленности. Это вспомогательное вещество для получения многих растворителей.
Сфера применения метилового спирта:
- Для изготовления растворителей
- В лакокрасочной промышленности
- При производстве биодизеля из масел
- Для борьбы с гидратами в газовой промышленности
Дело в том, что 30-100 мл метилового спирта может привести к судорогам и даже смертельному исходу. Соответственно ошибиться нельзя, так как это чревато плачевными последствиями. На вкус и запах спирты одинаковые. Не специалист по вкусу не отличит эти жидкости.
Способы проверить спирт:
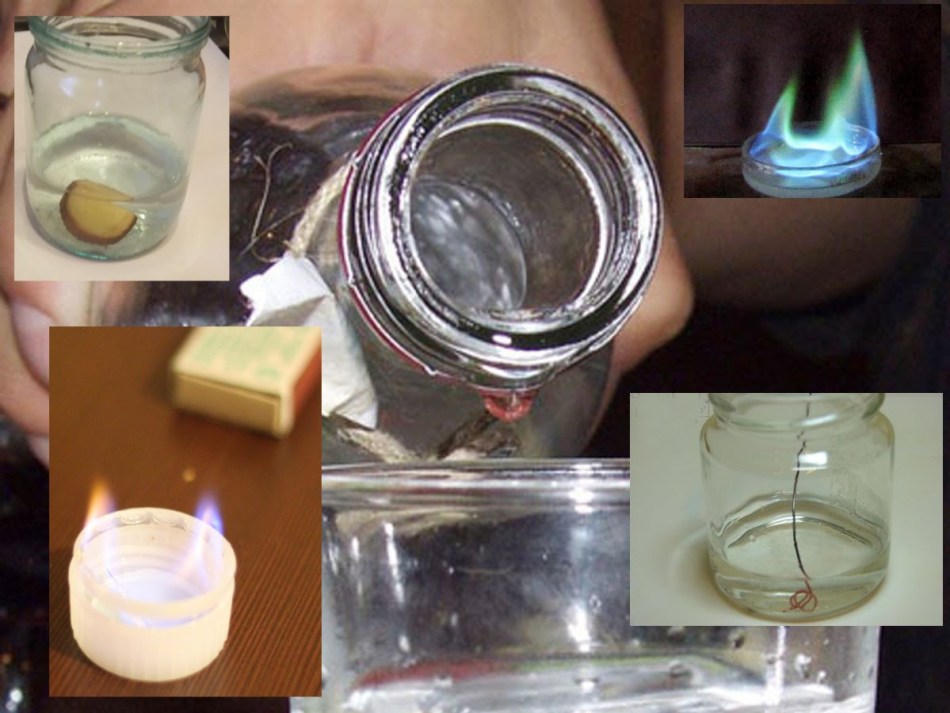
- Поджигание. Налейте в ложку немного жидкости и подожгите. Этиловый спирт будет гореть синим пламенем, а метиловый зеленым.
- Испытание картофелем. Очистите картофель и нарежьте на кусочки. Один ломтик погрузите в этанол, а второй в метанол. Если ломтик стал розовым, перед вами отрава, то есть метиловый спирт. В алкоголе картофель практически не меняет цвет.
- Медная проволока . Раскалите до черна кусочек медной проволоки, и окуните в жидкость. Если вы почувствуете запах уксуса, то спирт этиловый и его можно пить. Если запах будет неприятным, то спирт метиловый.

Ниже приведены формулы спиртов:
СН3ОН – метиловый спирт
С2Н5ОН – этиловый спирт

Как проверить спирт этиловый или метиловый в алкоголе – водке или самогоне, в домашних условиях?
Существует несколько способов определить подделку:
- Пищевая сода. Всыпьте в жидкость немного пищевой соды и наблюдайте за реакцией. Если имеются примеси метилового спирта, сода растворится полностью. Если продукт хорошего качества, то образуется желтый осадок и спирт пить можно.
- Марганцовка. Всыпьте в емкость с жидкостью марганцовку. Если на поверхности появятся пузыри, то спирт метиловый. Если нет, то этиловый.
- Кипячение. Это можно узнать при помощи термометра, температура кипения этанола 78 °С, а метанола 64 °С.
Этот метод тоже применяется для идентификации спирта. Этанол горит синим пламенем, а вредный метанол зеленым.

Этот индикатор реагирует на изменение кислотности. Самое интересное, что метиловый оранжевый изготовлен на основе метилового спирта. Поэтому при введении индикатора в метанол ничего не поменяется. Раствор будет оранжевым. Этанол имеет примерно нейтральную среду, поэтому и окраска существенно не изменится. Раствор будет оранжевым. Таким образом, при помощи индикатора отличить эти спирты нельзя.

Метиловый спирт является очень сильным ядом, он отличается нервно паралитическим действием. Примерно 30-100 мл метанола вызывает сильное отравление и судороги.
Симптомы отравления:
- Головокружение
- Сонливость
- Слюноотделение
- Нарушение координации движений
Чтобы потерять зрение достаточно выпить 10 мл, а чтобы умереть 30-100 мл.
 Метиловый спирт, метанол — влияние на организм человека: первые признаки и симптомы отравления, смертельная доза для человека
Метиловый спирт, метанол — влияние на организм человека: первые признаки и симптомы отравления, смертельная доза для человека
Если вы сомневаетесь в качестве алкоголя, то не пейте его. Но если все же вы не удержались, понаблюдайте за своим состоянием.
Проявление отравления:
- Мушки перед глазами
- Скачки давления
- Рвота
- Тошнота
- Обильные слюни
Вообще, метанол накапливается в организме, поэтому симптомы отравления могут появиться не сразу. В среднем действие метанола проявляется от 30 минут до 3 суток. И самое печальное, что на третьи сутки становится не лучше, а хуже. Можно заметить потерю зрения и редкое мочеиспускание. Это говорит, что почки плохо работают.

Первая неотложная помощь при отравлении метиловым спиртом, метанолом
Неотложная помощь:
- Положите пациента на живот, если он без сознания. Это поможет избежать удушья
- Дайте большое количество раствора пищевой соды
- Вызовите у больного рвоту
- Дайте больному слабительное
- Вызовите скорую помощь
Самое интересное, что противоядием является чистый спирт или хорошая водка. Необходимо каждые 3 часа по 50 г водки.

На самом деле последствия отравления очень печальные. Это может привести к смерти или слепоте.
Последствия:
- Потеря зрения
- Отказ почек
- Одышка
- Судороги
- Эпилепсия
- Цирроз

Варианты отравления при вдыхании паров:
- Отравление может произойти из-за попадания вещества на кожу при протирании лобового стекла. Чтобы этого не произошло, нужно заливать ее в автомобиль в хорошо проветриваемом помещении, используя перчатки.
- Отравиться метанолом можно на химическом производстве. Также метанол входит в состав некоторых красок, лаков и растворителей. Отравление может произойти в случае не соблюдения правил безопасности.
- А при покраске или уходе за автомобилем (с применением химических средств), нужно непременно соблюдать правила безопасности.
Метиловый спирт по вкусу и запаху мало чем отличается от этилового, поэтому будьте внимательны и не пейте сомнительные алкогольные напитки.
Каждому школьнику хорошо знаком лакмус — с его помощью определяют кислотность среды. Это вещество явля-ется кислотно-основным индикатором, т. е. обладает способностью обратимо изменять окраску в зависимости от кис-лотности раствора: в кислой среде лак-мус становится красным, а в щелоч-ной — синим. В нейтральной среде цвет лакмуса фиолетовый — это сочетание равных количеств синего и красного. Хотя лакмус уже в течение несколь-ких столетий верно служит людям, его состав так до конца и не изучен. В этом нет ничего удивительного: ведь лак-мус — это сложная смесь природных соединений. Он был известен уже в Древнем Египте и в Древнем Риме, где его использовали в качестве фиолето-вой краски — заменителя дорогостоя-щего пурпура. Затем рецепт приготов-ления лакмуса оказался утерян. Лишь в начале XIV в. во Флоренции вновь бы-ла открыта фиолетовая краска орсейль, тождественная лакмусу, причём способ её приготовления в течение многих лет держали в секрете.
При переходе от кислой среды к щелочной окраска лакмуса меняется с красной на синюю .
Готовили лакмус из специальных ви-дов лишайников. Измельчённые лишай-ники увлажняли, а затем добавляли в эту смесь золу и соду. Приготовленную та-ким образом густую массу помешали в деревянные бочки, добавляли мочу и вы-держивали длительное время. Постепен-но раствор приобретал тёмно-синий цвет. Его упаривали и в таком виде применяли для окрашивания тканей. В XVII столетии производство орсейли было налажено во Фландрии и Голлан-дии, а в качестве сырья использовали ли-шайники, которые привозили с Канар-ских островов.
Похожее на орсейль красящее веще-ство было выделено в XVII в. из гелио-тропа — душистого садового растения с тёмно-лиловыми цветками.
Знаменитый физик и химик XVII в. Роберт Бойль писал о гелиотропе: «Пло-ды этого растения дают сок, который при нанесении на бумагу или материю име-ет сначала свежий ярко-зелёный цвет, но неожиданно изменяет его на пурпурный. Если материал замочить в воде и отжать, вода окрашивается в винный цвет; такие виды красителя (их обычно называют «турнесоль») есть у аптекарей, в бакалей-ных лавках и в других местах, которые служат для окраски желе, или других веществ, кто как хочет». С того времени орсейль и гелиотроп стали использовать в химических лабораториях. И лишь в 1 704 г. немецкий учёный М. Валентин назвал эту краску лакмусом.
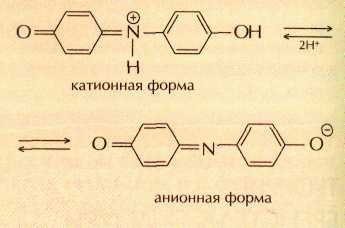
Сегодня для производства лакмуса измельчённые лишайники сбраживают в растворах поташа (карбоната калия) и аммиака, затем в полученную смесь добавляют мел или гипс. Считается, что красящими веществами лакмуса яв-ляются индофенолы, которые в кис-лой среде существуют в катионной форме, а в щелочной — в анионной, например:
В некоторых странах краску, сход-ную с лакмусом, добывали и из других растений. Простейшим примером служит свекольный сок, который также из-меняет цвет в зависимости от кислот-ности среды.

В сильнокислой среде индикатор метиловый оранжевый имеет красную окраску, в слабокислой и нейтральной — оранжевую, а в щелочной — жёлтую.
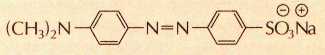
Метиловый оранжевый в щелочной среде.
В XIX в. на смену лакмусу пришли более прочные и дешёвые синтетиче-ские красители, поэтому использование лакмуса ограничивается лишь грубым определением кислотности среды. Для этой цели служат полоски фильтроваль-ной бумаги, пропитанные раствором лакмуса. В аналитической практике применение лакмуса ограничено тем, что по мере полкисления он изменяет окраску постепенно, а не в узком ин-тервале рН, как многие современные индикаторы. На смену лакмусу в анали-тической химии пришёл лакмоид — краситель резорциновый синий, кото-рый отличается от природного лакмуса по строению, но сходен с ним по окраске: в кислой среде он красный, а в щелочной — синий.

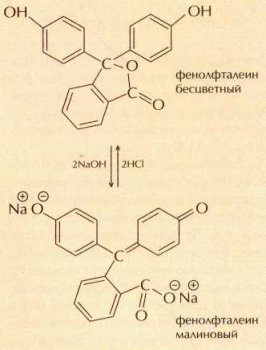
При увеличении рН до 8—8,5 окраска фенолфталеина изменяется с бесцветной на малиновую.
В наши дни известны несколько сот кислотно-основных индикаторов, ис-кусственно синтезированных начиная с середины XIX в. С некоторыми из них можно познакомиться в школьной хи-мической лаборатории. Индикатор ме-тиловый оранжевый (метилоранж) в кислой среде красный, в нейтральной — оранжевый, а в щелочной — жёлтый. Более яркая цветовая гамма свойствен-на индикатору тимоловому синему: в кислой среде он малиново-красный, в нейтральной — жёлтый, а в щелочной — синий. Индикатор фенолфтале-ин (он продаётся в аптеке под названи-ем «пурген») в кислой и нейтральной среде бесцветен, а в щелочной имеет малиновую окраску. Поэтому фенол-фталеин используют лишь для опреде-ления щелочной среды. В зависимости от кислотности среды изменяет окраску и краситель бриллиантовый зелёный (сто спиртовой раствор используется как дезинфицирующее средство — «зе-лёнка»). Для того чтобы проверить это, надо приготовить разбавленный раст-вор бриллиантового зелёного: налить в пробирку несколько миллилитров воды и добавить в неё одну-две капли аптеч-ного препарата. Раствор приобретёт красивый зелёно-голубой цвет. В силь-нокислой среде его окраска сменится жёлтой, а в сильнощелочной раствор обесцветится.
Однако наиболее часто в лабора-торной практике используется универ-сальный индикатор — смесь нескольких кислотно-основных индикаторов. Он позволяет легко определить не только характер среды (кислая, нейтральная, щелочная), но и значение кислотности (рН) раствора.

Индикатор тимоловый синий в кислой среде имеет малиново-красную, в нейтральной — жёлтую, а в щелочной — синюю окраску
